人类卵胞质内单精子注射(intracytoplasmic sperm injection, ICSI)技术开展至今已有30余年。其最初主要应用于针对严重少、弱、畸形精子症导致的男性不育患者的治疗,但随着未成熟卵体外培养、卵子冷冻、胚胎植入前遗传学检测等辅助生殖技术的开展, ICSI使用比例已大幅提升。虽然目前ICSI技术相对成熟,但仍有很多细节值得关注和完善。为规范与优化人类辅助生殖技术从业者的ICSI操作,由中国医师协会生殖医学专业委员会发起,并联合全国多家生殖医学中心共同编撰了本共识。

01 ICSI的适应证
01. 男性因素
① 极重度少精子症及弱精子症,即精子浓度<1×106/mL 及精子前向运动百分率<1%,处理后的前向运动精子总数不足 100 万。
② 特殊类型畸形精子症,如圆头精子症、大头精子症、无头精子症及精子鞭毛多发形态异常。
③ 精子功能异常。
④ 射精功能障碍。
⑤ 精子免疫性因素。
02. 非男性因素
① 需行 PGT 周期;
② IVM 周期;
③ 卵子冻融周期;
④ 不明原因前次常规IVF周期完全受精失败;
⑤ 前次周期卵子普遍存在透明带异常。
应将ICSI作为上述男性与非男性因素的授精方式。对于常规 IVF 授精有污染史且未能抗菌治愈的病例,仍然存在再次 IVF授精污染风险,可尝试选择ICSI。

02 ICSI周期中正常及常见异常形态卵子
通常情况下,仅对出现第一极体(Pb1)的核成熟卵子进行 ICSI 授精。本共识整理了正常及常见异常形态的卵子以作参考,详见图1。
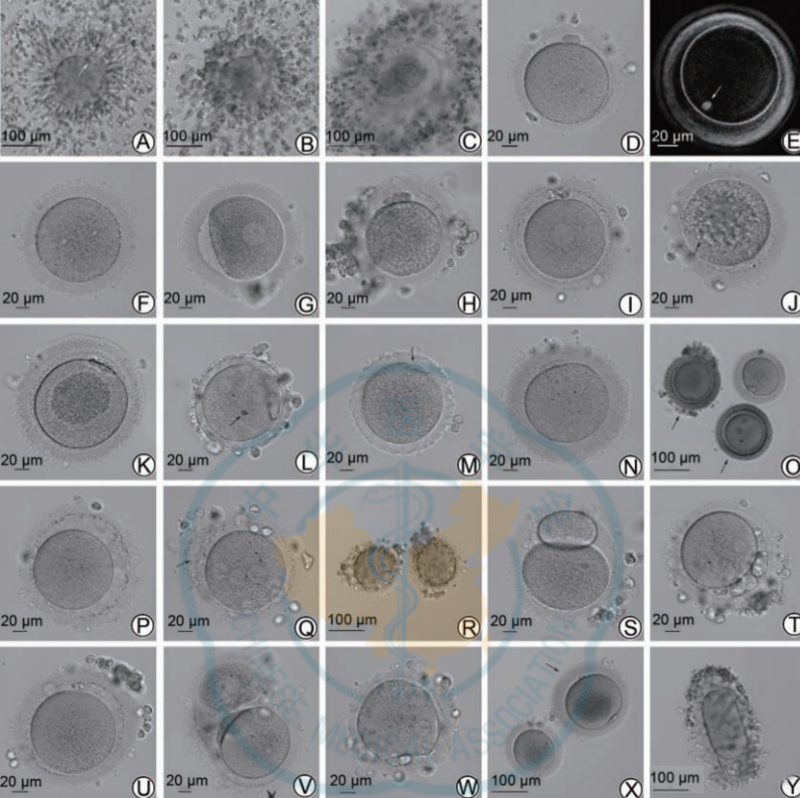
注:COC示卵丘-卵母细胞复合物;Pb1示第一极体;ZP示透明带;PVS示卵周间隙
图1 人类正常及常见异常卵子
A示COC(成熟卵子,卵丘细胞松散,箭头所示为Pb1);B示COC(未成熟卵子,卵丘细胞致密,未见Pb1);C示COC(退化卵子且透明带破裂);D示正常形态卵子;E示偏振光显微镜下正常形态卵子,纺锤体(箭头所示)位于极体正下方;F示MⅠ卵子;G示GV卵子;H示胞质粗糙,颗粒感明显且均匀;I示胞质可见滑面内质网簇,光滑似圆盘;J示胞质多发空泡(呈凹陷感,最大空泡直径约16 μm,箭头所示);K示胞质细胞器聚集,中央区域颗粒感明显;L示异常ZP,呈琼脂/蜡样、无PVS、胞质出现折光体(箭头所示,约5 μm);M示异常ZP,边缘呈锯齿状,Pb1呈月牙状(箭头所示),无PVS;N示ZP增厚(>20 μm为增厚);O示ZP着色,透明度下降(箭头所示卵子);P示PVS增大(至少可以容纳2个正常大小的Pb1);Q示ZP夹层(箭头所示);R示PVS内大量颗粒碎片;S示巨大Pb1(长径约80μm);T示多Pb1且较大;U示Pb1碎片化且PVS增大;V示连体卵子;W示胞膜不规则;X示巨大卵子(箭头所示,总体平均直径约230 μm,胞质平均直径约150μm),双Pb1,胞质细胞器聚集;Y示长椭圆形巨大卵子;滑面内质网簇(SERc)、大空泡(直径>14 μm)或多发小空泡、胞质细胞器聚集、锯齿或蜡样透明带以及多重异常形态卵子会对受精、胚胎发育及妊娠结局产生较大的负面影响,但部分卵子通过ICSI仍然可以获得健康活产婴儿,因此建议这部分卵子进行特殊标记并不作为移植选择。
03 卵子的显微注射
01. 显微操作系统
显微操作系统应安置在百级净化区域(ISO Class5),该区域应相对独立、安静且人员流动较小,远离门口和传递窗口,尽量避免高效滤器出风口直吹操作台面和操作人员,这样可以保障操作环境稳定,使操作人员免受外界因素干扰而更加专注。除此之外,与显微操作相关的培养箱应尽量靠近显微操作设备,增加操作流程的顺畅度,减少配子或胚胎在外界暴露的时间。
02. ICSI操作皿的制备
ICSI操作皿各类微滴的具体布局没有统一标准,可根据个人操作习惯制备,但应遵循如下基本原则及参考技巧:①操作液微滴应尽量集中于皿的中部,以避免操作针下降时触碰皿的侧壁;②如果是极重度少、弱精或睾丸/附睾精子,也可不用制作PVP微滴,直接将精子悬液制成微滴;③建议双人制皿,及时覆盖培养油,避免因挥发而改变液滴渗透压。
03. 显微操作针的安装
① 安装时避免注射针内产生大量气泡;
② 操作针在插入持针器过程中如遇到较大阻力时切勿强行插入,应检查持针器管路内是否有破损的玻璃残留物;
③ 若发现操作针吹吸不顺畅,尤其是无法稳定控制注射针内的精子时,应首先检查装针位置和水晶螺母松紧度;当确保装针到位并拧紧水晶螺母后上述问题仍未解决,应考虑是水晶螺母内的密封胶垫出现了老化或破损,需及时进行更换;
④ 将安装好的操作针在低倍物镜(4×或10×)下进行调焦,并使注射针和持卵针成一条直线;
⑤ 注射针前端角度并非与皿底完全平行,但角度不宜过大,以成功压停运动精子的最小角度为佳。
04. 卵子的脱颗粒
建议卵子在透明质酸酶中作用的时间<30 s。脱颗粒的总时间控制在1~2 min内,因此不建议一次操作过多的卵子(5~8 枚为宜)。建议使用口径(内径)递减的烧拉制成的玻璃吸管或商品化剥卵针逐步进行卵子脱颗粒:通常先用管口烧制光滑的巴斯德吸管在酶中进行吹吸消化、随后用内径200 μm左右的吸管转移至干净配子缓冲液中、然后用内径 160~180 μm 的吸管/拨卵针进行“粗拆”、最后用内径 135~140 μm的吸管/拨卵针将颗粒细胞剥离干净;脱颗粒后的卵子应进行充分洗涤,最后移入卵裂培养液中孵育至少1 h。
05. 显微注射基本步骤
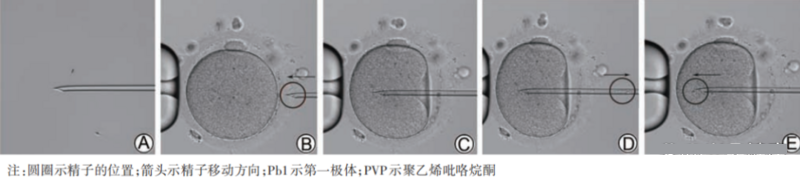
图2 显微注射过程(200×)
A示轻压精子尾部中段或下段进行制动;B示调整 Pb1位置并固定卵子,针尖抵住透明带后将精子移到针尖处;C示突破透明带并刺入胞质,但此时并未破膜;D示当胞质瞬时流入针内时(破膜),即刻终止负压;E示精子进入胞质,应避免注入PVP
将精子注入胞质内是受精的关键。精子头颈部顺利滑出针尖,并且撤针后不随胞膜的回弹而持续后移,即标志着精子成功注入胞质。当观察到破膜成功,但精子在注入时明显受阻而依然停留在针尖内侧,并且在撤针后精子会沿穿刺通道缓慢向外移动,表明回吐的胞膜“褶皱”阻碍了精子的进入。如遇此种情况,可以进行二次回吸胞质,然后再重新注入精子;或者平行于第一次穿刺通道位置进行二次穿刺,重新破膜后再注入精子。经过第一次穿刺拉伸后的胞膜,通常在二次穿刺时仅需轻微负压甚至无需负压即可破膜。推荐在200 ×~400 ×放大倍数下进行精子的制动和卵子的注射。
06. 精子的制动
对于精子的制动,成功阻止前向运动及尾部摆动即可;精子制动后尽快进行注射,不建议提前制动足够数量的精子后再进行注射。对于极重度少精患者,为避免卵子外界暴露时间过长,可以提前抓取足够数量的精子,但不提前进行制动。
07. ICSI 过程中极体摆放的位置
建议将 Pb1 置于 12 点或 6 点位置,于3点或9点位置(左手进针者)进行穿刺。使用显微注射针轻压卵子透明带,使Pb1旋转至穿刺焦距平面最清晰位置。
08. 注射针穿刺深度
建议穿刺深度为胞质直径的1/2~2/3为宜。但对于发生突然破膜(无穿刺漏斗形成)的卵子则不建议继续进针,可直接将精子注入胞质。
04 受精观察
尽管有研究报道,通过 PGT 筛选正常双亲二倍体胚胎可以获得健康婴儿,但考虑到较低的正常胚胎率和较高的检测成本,建议丢弃ICSI-1PN 来源的胚胎。ICSI-0PN 来源的胚胎可能是原核出现过早或过晚而错过了观察时间。鉴于高质量 ICSI-0PN 来源的胚胎具有与 ICSI-2PN 来源胚胎近似的正常染色体发生率、双亲二倍体比例以及妊娠结局,建议对高质量 ICSI-0PN来源胚胎行囊胚培养,形成可利用囊胚,经充分知情同意后再行移植或冷冻保存。
05 ICSI特殊情况的应对及其他细节

01. 第一次减数分裂(MⅠ)
中期卵子的处理
对于卵子成熟率较低(<50%)或高龄(≥40岁)的患者,可对 MⅠ卵进行短时间的体外培养(取卵后8 h内),从而增加卵子利用率及可用胚胎数量,但鉴于其较高的非整倍体率及不良妊娠结局,有条件的可酌情对形成的囊胚进行PGT-A检测。
02. 易退化卵子的应对
脱颗粒过程中应避免高频率、大幅度吹吸,剥卵针内径不应<135 μm;避免过度剥离颗粒细胞,残余颗粒细胞不影响卵子的观察和注射即可;当出现精子或胞质黏针严重时,应及时更换ICSI针;ICSI针前端水平角度不宜过大;对于卵膜脆性较高的卵子,建议适当延长孵育时间,再行ICSI。
03. 无透明带卵子的处理

图3 人类无透明带卵子行卵胞质内单精子注射及胚胎发育情况
A示固定卵子;B示穿刺胞膜;C示注入精子;D示第1天正常受精;E示第3天 8-细胞胚胎;F示第5天囊胚
ICSI过程中,Holding针负压不宜过大,ICSI针刺入不宜过浅;由于观察不到 Pb1,有条件的可以利用偏振光显微镜确认纺锤体位置后再行 ICSI;ZFOs 来源的卵裂期胚胎在移植或冷冻过程中容易发生解体,因此建议进行囊胚培养;为避免养囊换液过程中卵裂球分解,可以直接将培养微滴中的卵裂期培养液移除并重新注入囊胚培养液,或者使用一步培养液;建议对 ZFOs 进行单滴培养或应用时差成像系统进行培养。
04. ICSI完全受精失败的应对
AOA 应谨慎应用,建议对前次 ICSI受精完全失败或受精率低下的患者进行患者精子与供者卵子的交叉试验、鼠卵激活试验(MOAT)或精子的PLC ζ染色,来判断
精源性或是卵源性OAD;可对Ⅰ型圆头精子症或精源性OAD的病例进行AOA治疗;常用化学法激活剂包括离子霉素、A23187以及氯化锶。三者之间的效果比较尚存争议,但对于单独应用上述3种激活剂临床治疗效果不佳的患者,可尝试联合应用。
05. 完全不活动精子的应对
ICSI过程中,将完全不活动精子中的活精子和死精子进行区分至关重要,因为死精子无法激活卵子而发生正常受精。常用的存活精子鉴别方法包括人工精子激活(ASA)、低渗膨胀试验(HOST)、激光辅助不动精子选择(LAISS)、精子尾部柔韧性测试(STFT)。
虽然上述四种方法存在各自的优缺点,但IVF实验室应至少采用其中一种用于不动精子的ICSI处理;鉴于ASA的安全性尚不明确,因此应谨慎应用;HOST和LAISS可以作为ASA无效病例的备选方法,但尚无证据表明两者哪个更具优势,可以根据实验室操作习惯及设备条件进行选择应用;STFT方法通常可以结合HOST和LAISS方法使用。
当使用 HOST时,精子在低渗液中暴露时间应少于 30 s。
06. 精子的优选
目前还没有可靠的技术可以彻底筛除 DNA 碎片化的精子,并且这些技术的安全性和有效性有待商榷,因此不建议将上述方法进行常规应用;对于精子DNA 碎片指数(DFI)>20%~30% 且具有不良预后因素(高龄、卵巢功能低下、反复种植失败/流产)的病例可以尝试上述方法进行精子的优选,但由于相关研究缺乏前瞻性和随机性,因此目前尚无法推荐好的精子优选技术;若DFI持续较高且反复 ICSI 周期失败2次以上可考虑从睾丸中获取精子。
07. 其他细节
(1)卵子孵育、脱颗粒及ICSI时机的选择:
取卵后 2~6 h 或人绒毛膜促性腺激素(hCG)扳机后 38~42 h 内进行脱颗粒及 ICSI;建议脱颗粒后孵育 1 h再行ICSI;预后不良的患者可以利用纺锤体观测仪评估卵子核-质同步性,对于未见纺锤体的 MⅡ卵可以适当延后ICSI时间。
(2)PVP的浓度:
建议根据个人技术能力和习惯将PVP进行适当稀释,5%的PVP是很好的选择,一方面降低高浓度PVP对卵子发育潜力的负面影响,另一方面也几乎不增加精子制动操作的时长。
(3)透明质酸酶的浓度:
商品化透明质酸酶(80 U/mL)可以直接应用。同时建议在不影响脱颗粒效果和时间的前提下可以进行稀释应用。
质控指标
根据2017年维也纳共识及2018年中国胚胎实验室关键指标质控专家共识,将ICSI实验室质控指标的计算方式及标准归纳如下,详见表1。
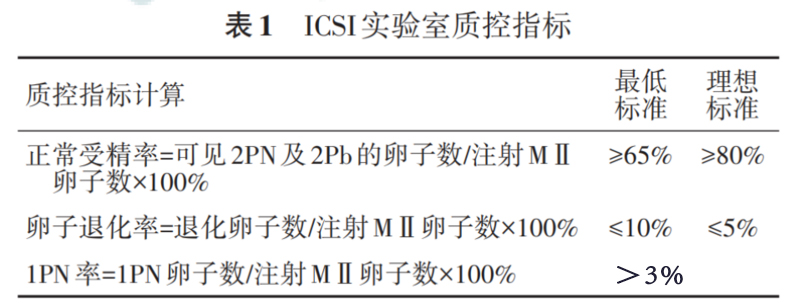
注:正常受精率和卵子退化率为关键质控指标;1PN率为一般质控指标;退化卵子定义为ICSI过程中出现胞质崩解及受精观察时发现凋亡的卵子;ICSI示卵胞质内单精子注射;PN示原核;Pb示极体
① 新人要充分了解ICSI的理论基础及影响因素。只有熟练掌握捡卵、胚胎转移、卵子脱颗粒等基础技能的新人才可以开始训练 ICSI 操作;
② 训练期间可以使用未受精或废弃的IVM卵子进行练习。当新人的平均每卵操作时间(从制动精子开始,至注射结束)与带教胚胎学家相当、废弃IVM 卵子受精率>60%、卵子退化率<10% 时,方可进行患者卵子的操作;
③ 新人在正式操作患者卵子初始阶段,可以注射获卵数较多患者(>10枚卵子)的部分卵子。至少注射 50 枚卵子后,当受精率及卵子退化率与胚胎学家注射的同批卵子结果相当时,方可进行独立操作。



